Das Heilmittelgesetz (HMG) kommt erneut auf den Prüfstand. Durch die aktuelle Teilrevision will der Bundesrat „im Bereich der Arzneimittel für neuartige Therapien (…) angemessene und klarere Regelungen“ einführen. Dadurch soll der Bevölkerung Zugang „zu innovativen und qualitativ hochstehenden Therapien und neuen Produkten“ offenstehen. Die Schweizerische Evangelische Allianz (SEA) hat nun mit einer kritischen Antwort auf die Vernehmlassung reagiert.
Von Ursula Baumgartner
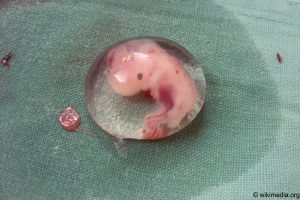
Arzneimittel für neuartige Therapien (Advanced Therapy Medicinal Products, ATMP) unterscheiden sich „in Bezug sowohl auf ihre Wirkungsweise als auch auf ihre Biologie mitunter sehr stark voneinander“, heisst es im „Erläuternden Bericht zur Änderung des Heilmittelgesetzes“. Sie „enthalten oder bestehen häufig aus lebenden Zellen oder Geweben, die biotechnologisch aufgearbeitet werden“. Dies betrifft auch embryonale Stammzellen und Gewebe.
SEA reagiert kritisch
Hier setzt die Kritik der SEA an. Denn die neue Version des HMG würde die Möglichkeit eröffnen, „menschliche Organe, Gewebe oder Zellen aus Embryos und Föten entnehmen zu können, um damit Arzneimittel (…) herzustellen“. Das Material könnte beispielsweise aus überzähligen Embryonen aus der Reproduktionsmedizin stammen. Langfristig könnte die neue Version des HMG daher einen Anreiz bieten, künstlich weitere „überschüssige Embryonen zu produzieren“. Die „Würde und Unantastbarkeit menschlichen Lebens“ schliesse aber auch Embryonen und Föten mit ein. Daher fordert die SEA hier „zwingend eine ethische Beurteilung“. In der Schweiz wurden im Jahr 2021 etwa 15‘600 sog. überzählige Embryonen vernichtet. Ihre Zahl sollte durch das neu revidierte Gesetz nicht noch zusätzlich steigen.
Dies ist aber nicht der einzige Kritikpunkt der SEA. Es bestehe zudem die Gefahr der „Kommerzialisierung von Arzneimitteln, welche mit Organen, Geweben oder Zellen hergestellt wurden“. Das Transplantationsgesetz verbietet den Handel mit menschlichen Organen, Geweben oder Zellen. Der Umgang mit Arzneimitteln jedoch, die aus solchen gewonnen wurden, sei im neuen HMG bislang nicht reguliert.
Dies alles wirft ethische Probleme auf. So stellt die SEA zu guter Letzt die Frage, wie und ob Patienten Informationen darüber erhalten können, wie die Arzneimittel hergestellt werden. Ihnen müsse die Möglichkeit offenstehen, Therapien und Medikamente „aus ethischen Überzeugungen abzulehnen“.
Die vollständige Vernehmlassungsantwort der SEA finden Sie hier: www.each.ch